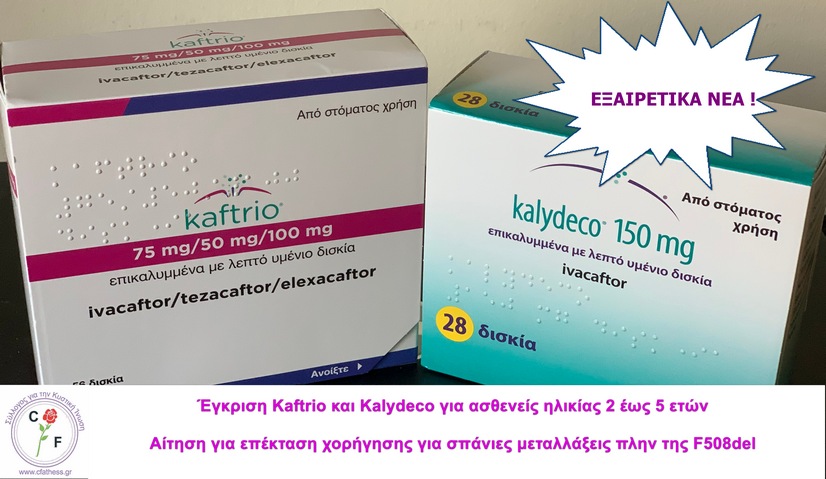
Έγκριση του KAFTRIO σε συνδυασμό με Kalydeco για παιδιά ηλικίας 2 έως 5 ετών. Αίτηση της εταιρίας για επέκταση χορήγησης του φαρμάκου Kaftrio και Kalydeco σε ασθενείς με άλλες σπάνιες μεταλλάξεις πλην της F508del.
Εγκρίθηκε το KAFTRIO σε συνδυασμό με Kalydeco για παιδιά ηλικίας 2 έως 5 ετών.
Αίτηση της εταιρίας για επέκταση χορήγησης του φαρμάκου Kaftrio και Kalydeco σε ασθενείς με άλλες σπάνιες μεταλλάξεις πλην της F508del.
Στις 23 Νοεμβρίου 2023 η εταιρία Vertex Pharmaceuticals ανακοίνωσε ότι η αρμόδια Ευρωπαϊκή Επιτροπή ενέκρινε την χορήγηση του Kaftrio σε συνδυασμό με το φαρμακευτικό σκεύασμα Kalydeco για τη θεραπεία παιδιών με κυστική ίνωση (CF) ηλικίας 2 έως 5 ετών που έχουν τουλάχιστον μία μετάλλαξη F508del στην γονίδιο CFTR που είναι υπεύθυνο για την εμφάνιση της Κυστικής Ίνωσης.
Η εξέλιξη αυτή είναι ιδιαίτερα σημαντική για τους ασθενείς, γιατί ο συγκεκριμένος φαρμακευτικός συνδυασμός του Kaftrio με τον Kalydeco έχει βελτιώσει αισθητά την ζωή και την υγεία όσων ασθενών ήταν επιλέξιμοι και μπορούσαν να το λάβουν. Με την απόφαση αυτή της επιτροπής, πλέον και τα μικρά παιδιά στην Ευρώπη ηλικίας 2 έως 5 ετών μπορούν να λάβουν το συγκεκριμένο φάρμακο που στοχεύει στο αίτιο της νόσου και επιβραδύνει την εξέλιξη της. Μέχρι στιγμής το φάρμακο είχε εγκριθεί και χορηγούνταν σε ασθενείς ηλικίας 6 ετών και άνω που είχαν μια έχουν τουλάχιστον μία μετάλλαξη F508del στην γονίδιο ( CFTR ) που είναι υπεύθυνο για την εμφάνιση της Κυστικής Ίνωσης.
Νέα αίτηση της εταιρίας για επέκταση χορήγησης του φαρμάκου και για όσους έχουν άλλες μεταλλάξεις πλην της F508del που ανταποκρίνονται στη θεραπεία
Επίσης, η εταιρία ανακοίνωσε στις 24 Νοεμβρίου 2023 την επικύρωση του Ευρωπαϊκού Οργανισμού Φαρμάκων για την επέκταση της αίτησης για την άδεια κυκλοφορίας του συγκεκριμένου φαρμακευτικού συνδυασμού Kaftrio και Kalydeco για ασθενείς με Κυστική ίνωση με σπάνιες μεταλλάξεις που ανταποκρίνονται στο φάρμακο. Εφόσον εγκριθεί από την αρμόδια επιτροπή η αίτηση της εταιρίας για επέκταση της εγκεκριμένης ένδειξης, θα προστεθούν στην άδεια χορήγησης του φαρμάκου ακόμα 200 περίπου μεταλλάξεις CFTR που δεν είναι F508del, αλλά ανταποκρίνονται στο φάρμακο. Η νέα αυτή αίτηση αφορά ασθενείς ηλικίας 2 ετών και άνω που έχουν μια μετάλλαξη στο γονίδιο (CFTR) η οποία ανταποκρίνεται με βάση κλινικά και/ή in vitro δεδομένα, συμπεριλαμβανομένης της μετάλλαξης N1303K.
Η αίτηση επέκτασης της χορήγησης του φαρμάκου, θα εξεταστεί τώρα από την Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση, η οποία θα εκδώσει γνώμη στην Ευρωπαϊκή Επιτροπή σχετικά με την έγκριση της ή όχι. Για οτιδήποτε νεώτερο θα σας ενημερώσουμε άμεσα.